1403 · チオシアン酸イオン SCN ー 1 次亜塩素酸イオン ClO ー 1 亜塩素酸イオン ClO 2 ー 1 塩素酸イオン ClO 3 ー 1 過塩素酸イオン ClO 4 ー 1 過マンガン酸イオン MnO 4 ー 2 クロム酸イオン CrO 4 2ー 2 ニクロム酸イオン Cr 2 O 7 2ーフッ化水素 hf 1価の酸 塩化水素 hcl 臭化水素 hbr ヨウ化水素 hi 硝酸 hno 3 酢酸 ch 3 cooh 硫酸 h 2 so 4 2価の酸 シュウ酸 (cooh) 2 二酸化炭素 co 2 硫化水素 h 2 s リン酸 h 3 po 4 3価の酸 水酸化ナトリウム naoh 1価の塩基 水酸化カリウム koh アンモニア nh 3 水酸化カルシウム ca(oh) 2 2価の塩基1400 · 固体のクエン酸には、「 無水物 むすいぶつ 」と「 一水和物 いちすいわぶつ/いっすいわぶつ 」が存在します。 無水クエン酸 とは、クエン酸分子のみでできた固体(化学式:C 6 H

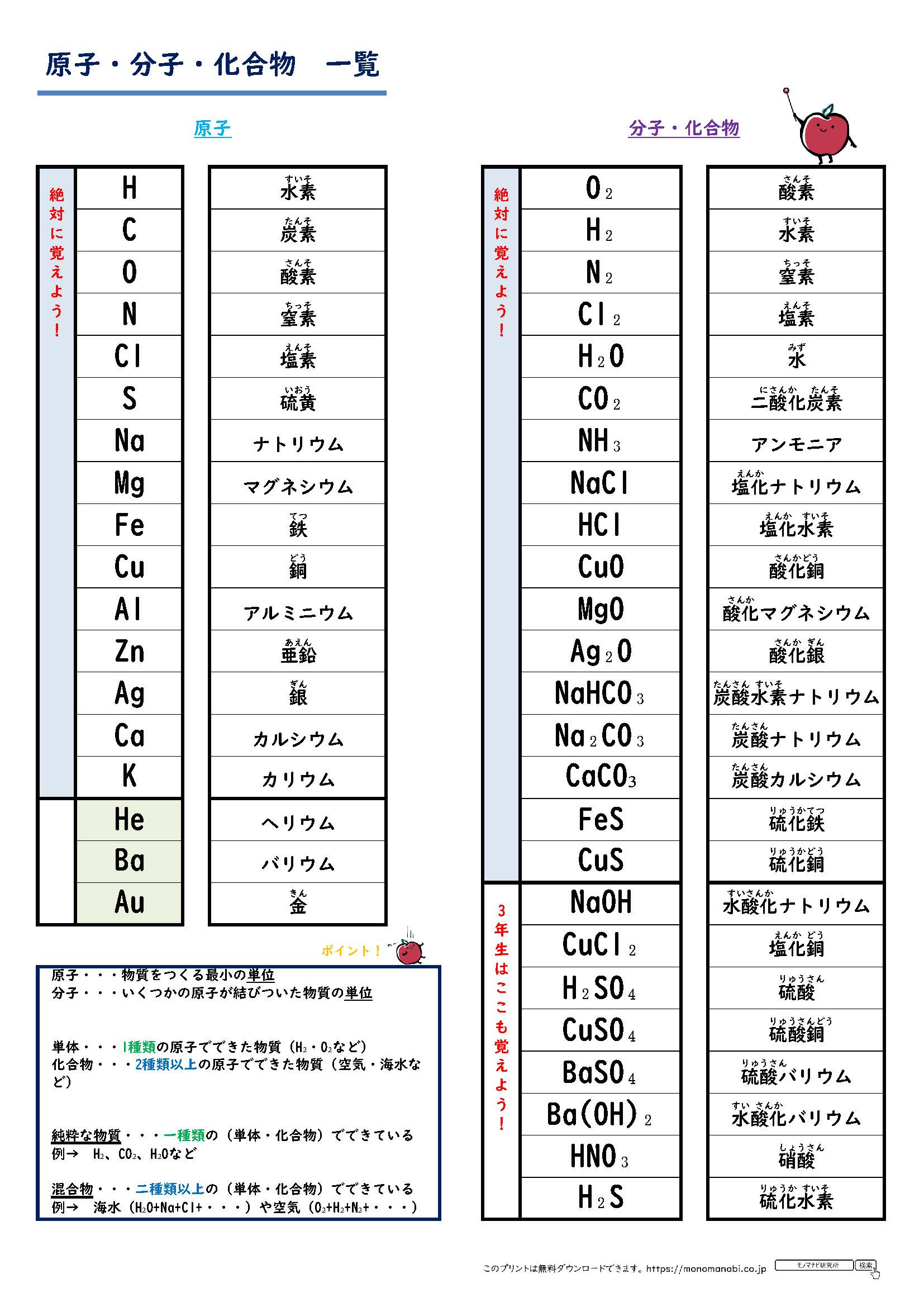
化学式とは 受験化学で覚えておくべき化学式を一覧にまとめてみた 化学受験テクニック塾
酸 化学式 一覧
酸 化学式 一覧-実験の章では,大阪府高等学校理化教育研究会編「化学 I 実験書」を参考にしています。 熱と熱量,反応熱,熱化学方程式,いろいろな反応熱 ヘスの法則,固体の水酸化ナトリウムと塩酸の反応,固体の酸化カルシウムと塩酸の反応現在,次の13種の化合物がビタミンと認定されている。 ビタミンA, B 1, B 2, B 6, B 12, C, D, E, K, 葉酸, ナイアシン, ビオチン, パントテン酸 ビタミンは,水に溶け易い 水溶性ビタミン と,水に溶け難い 脂溶性ビタミン に大別される。 これらは体内での用途




強酸と弱酸まとめ 見分け方 理系ラボ
0421 · HCl(塩酸)→ H Cl - HBr(臭化水素酸)→ H Br - HI(ヨウ化水素酸)→ H I - HNO 3 (硝酸)→ H NO 3- 1価 HF(フッ化水素酸)→ H F - CH 3 COOH(酢酸)→ H CH 3 COO - H 2 SO 4 (硫酸)→ 2H SO 42- 2価 H 2 CO 3 (炭酸)→ 2H CO 32- H 2 S(硫化水素)→ 2H S 2- H 2 C 2 O 4 (シュウ酸)→ 2H C 2 O 42- または (COOH) · アミノ酸とは何か簡単に解説! アミノ酸は「 アミン (ーNH2) 」と「 酸 (COOH) 」からできている物質です。 アミノ酸はたくさんの種類がありますが、 基本的には上の構造のRの部分が変化するだけ です。 RがHになったものはグリシン、メチル基 (Me)はアラニンなどRの部分が変化してアミノ酸は変化します。 この Rの部分を「側鎖」 と呼びます。添加物名 用途 有害作用 製品名 赤色2号、赤色3号 赤色104号、赤色105号 赤色106号、青色1号
床上操作式クレーン運転技能特例講習 91 10 小特 小型移動式クレーン運転技能特例講習 92 27 ボ講 ボイラ取扱講習 93 28 ボす ボイラすえ付け工事作業主任者講習 94 29 一圧 第一種圧力容器取扱作業主任者技能講習 95 32 プ作 プレス機械作業主任者半反応式 半反応式とは、酸化還元反応で使用される化学反応式のことです。 電子( e) を含んでいることが特徴です。 例えば、過マンガン酸カリウムの水溶液中での反応は、 MnO4+8H+5e→Mn2+4H2O と表されます。 ここでは一般に、パルミチン酸などの脂肪酸を化学式に含むものを、「油脂」という場合が多い。 動植物の体内の「油」や「脂肪」といわれるものには、この組成(グリセリン (C 3 H 5 )OHと脂肪酸とのエステル)のものが多いので、(特別あつかいしてか、)「油脂」という用語がある。
海外協定大学一覧 理学部 化学科 メニュー ペプチドとは ペプチドはアミノ酸が結合したもの アミノ酸とアミノ酸がペプチド結合(-conh)して、2個以上つながった構造のものを『ペプチド』とい化学式・・・銅 (Cu), 酸素 (O2)、酸化銅 (CuO)212 入試頻出の3大オキソ酸の化学式(分子式と構造式) 213 天然高分子の分子式と構造式;




トップ 100 化合物 化学式 一覧 マインクラフトの最高のアイデア




酢酸 電離 式 酸と塩基 電離平衡
第1節 熱化学方程式 A 熱量と比熱 熱量(heat quantity) 熱を数量的に表した,測定される量を熱量という。 単位は力学的な仕事の単位と同じジュール〔J〕を用いるが,カロリー〔cal〕を用いることもある。 1calは常圧下で温度145℃の水1gを温度155℃まで1Kだけ化学名:プテロイルグルタミン酸 ビオチン 化学名:ビオチン ビタミンc 化学名:アスコルビン酸 ビタミンcは、壊血病治療の研究から発見され、抗壊血病(アンチスコルビック)の名称から、この化学名が命名されました。一般式 構造式 エテン=エチレン C 2 H 4 プロペン=プロピレン C 3 H 6 ブテン=ブチレン C 4 H 8



永久保存版 無機化学の反応はたった6つ 受験メモ



リン酸ナトリウム You Iggy
· 覚えなくていい? 高校化学の化学式一覧 21 分子式一覧 211 超基本的な有機物脂肪族の分子式と構造式;前回まで 前回は、塩とは何なのか?そして塩を生成する酸塩基反応の化学反応式を実際に一緒に解いてみました。実は塩も1種類だけではなくいろんな種類のものがあります。 今回は、その塩の種類についてみてみましょう。 塩の種類 塩は、酸性塩・塩基性塩・正塩2419 · 高級脂肪酸(炭素数・覚え方・種類・一覧・構造式・分子量など) プロ講師解説このページでは『油脂の構成要素の1つである高級脂肪酸(種類一覧や構造式、分子量、炭素数、融点、水溶性など)』について解説しています。 解説は高校化学・化学基礎を扱うウェブメディア『化学のグルメ』を通じて6年間大学受験に携わるプロの化学講師が執筆し



化学式とは その意味から大学受験に役立つ化学反応式の覚え方まで Studyplus スタディプラス




組成 式 一覧 元素 化合物の種類と化学式の一覧
NH 3 H 2 O → NH 4 OH06 · 北海道大学創成研究機構化学反応創成研究拠点(wpiicredd)の美多 剛特任准教授及び同拠点拠点長・同大学院理学研究院化学部門の前田 理教授らの研究グループは,コンピュータ上で可能性のある反応経路を予測し,得られた計算結果を合成化学実験によって具現化することで,αアミノ酸ニッケルホスフィン錯体試作品 物質名 ジクロロビス (トリフェニルホスフィン)ニッケル (Ⅱ) 化学式 (C 6 H 5) 3 P 2 NiCl 2 CAS No 用途 グリニャール試薬のクロスカップリング反応用触




セ対 これだけは覚える 化学式一覧 高校生 化学のノート Clear
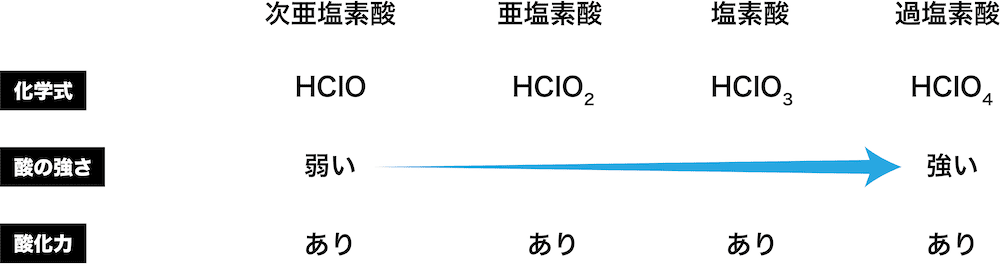



オキソ酸 例 酸化力 一覧 強さ 構造 酸化数など 化学のグルメ
アスパラギン酸 A sp D グルタミン酸 G lu E ヒスチジン H is H リシン Lys K アルギニン A rg R 一文字表記の青色文字は,三文字表記の頭文字と一致しないアミノ酸化学式 分子量 cas番号 官報公示整理番号;有機化学Ⅰ 講義資料 第2回「酸と塩基」 – 2 – 名城大学理工学部応用化学科 の共役酸はnh 4である。共役は「きょうやく」と読む。「きょうえき」ではないので注 意すること。 この反応式を見て、「あれ、水って酸なの? 中性じゃん?



主な化学反応式一覧 中学理科で登場する化学反応式のまとめ 教科書をわかりやすく通訳するサイト




第1節 熱化学方程式
フッ化物イオン塩化物イオン臭化物イオンヨウ化物イオン酸化物イオン炭酸イオンF 炭酸水素イオンCl 硫酸イオンBr 硫酸水素イオンI 酢酸イオンO2 リン酸イオン NH4Pニトロ安息香酸 pnitrobenzoic acid $_\ce{no2c6h4cooh}_$ (3)1505 詳細はこちら アジピン酸 adipic acid $_\ce{hooc(ch2)4cooh}_$ (2)858 詳細はこちら アゼライン酸 azelaic acid $_\ce{hooc(ch2)7cooh}_$ 1 (2)878 詳細はこちら ドデカン二酸えば、下の反応式では、h 2oがhを受け取っているから、h 2oは塩基として働いてい る。 また、多くの酸塩基反応は可逆であり、速やかに平衡に達することが多い。このこと を明記するため、酸塩基反応を書く場合は、「化学平衡を表す両矢印」を使う(注3)。




高校化学基礎 単原子イオンと多原子イオン 映像授業のtry It トライイット



19年09月15日 高分子 ミクロの世界
· 酸化 さんか ( 燃焼 ねんしょう )の化学反応式一覧 酸化とは :物質が酸素と化合すること。 酸化の中でも、熱や光を発しながら激しく酸化することを燃焼という。 水素の燃焼(水の合成) 2H2 O2 → 2H2O 水素が酸化して水になる。 炭素の完全燃焼 C O2 → CO2 炭素が酸化して二酸化炭素になる。 · 化学式(hcooh)で表される分子量が最小のカルボン酸。漢字では蟻酸と書き、蟻の体から見つかったことに由来します。近年、水素貯蔵材料としても注目されており、その観点からco 2 とh 2 からの合成法が数多く報告されています。 ※2 アルケン · CH 3 COOH(酢酸)→ H CH 3 COO - H 2 SO 4 (硫酸)→ 2H SO 42- 2価 H 2 CO 3 (炭酸)→ 2H CO 32- H 2 S(硫化水素)→ 2H S 2- H 2 C 2 O 4 (シュウ酸)→ 2H C 2 O 42- または (COOH) 2 (シュウ酸)→ 2H (COO) 22- 3価 H 3 PO 4 (リン酸)→ 3H PO 43-




化学式とは 受験化学で覚えておくべき化学式を一覧にまとめてみた 化学受験テクニック塾




日本石鹸洗剤工業会 石けん洗剤知識
· 化学反応式の検索フォームのようなものです。 最初に化学式データと化学反応式データをインポートしてから検索する 仕様になっています *化学反応式の登録に備考欄を追加しました() *サンプルデータを修正しました gi




Microsoft Word Chemformbook Docx Pdf 無料ダウンロード



化学式の一覧や覚え方 中学生が覚えておきたい化学式 三重の個人契約家庭教師




強酸と弱酸まとめ 見分け方 理系ラボ




日本石鹸洗剤工業会 石けん洗剤知識




高校化学 マレイン酸とフマル酸 映像授業のtry It トライイット




完全版 酸 塩基の価数の意味 覚え方 一覧と多段階電離 サイエンスストック 高校化学をアニメーションで理解する




高校生 化学 化学式のノート一覧 Clear



酢酸 と 水 酸化 ナトリウム の 中 和 反応 式 酸と塩基 中和反応



ゴロでも何でもいいので 高度さらし粉の 化学式の覚え方を教えてください Yahoo 知恵袋



ここにある化学式の簡単な覚え方 語呂合わせなど ってありませんか Yahoo 知恵袋




化学式とは 受験化学で覚えておくべき化学式を一覧にまとめてみた 化学受験テクニック塾




試験 テストに出る化学反応式一覧 中学理科 高校入試の要点まとめ Yattoke 小 中学生の学習サイト




化学式とは 受験化学で覚えておくべき化学式を一覧にまとめてみた 化学受験テクニック塾




フライング エッグ株式会社 今回の開発商品ポスターは 化学式一覧表 です Facebook




酸 塩基の価数の意味 覚え方 一覧と多段階電離 Vicolla Magazine



化学式 一覧 中和反応式 一覧 中和反応でできる 塩の種類と性質 中学理科



102 101 105 解説一覧 Yaku Tik 薬学まとめました




酸 塩基 価数 一覧 覚え方 例など 化学のグルメ




中3理科 酸とアルカリの実験のポイント Examee
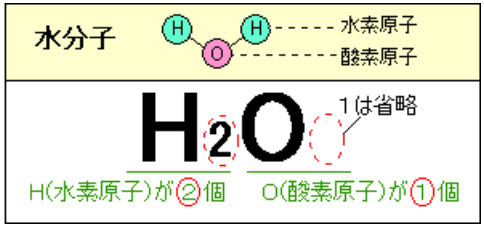



化学式の一覧や覚え方 中学生が覚えておきたい化学式 三重の個人契約家庭教師
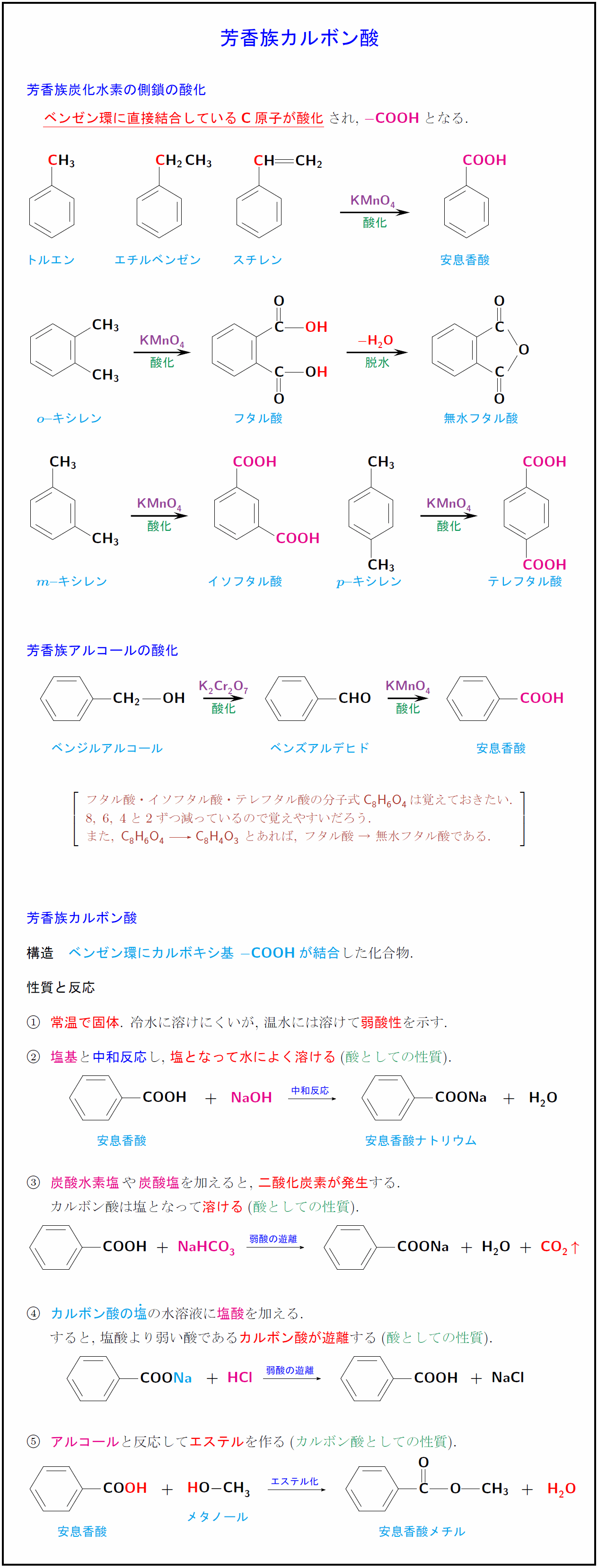



高校有機化学 芳香族カルボン酸 安息香酸 フタル酸 の構造 性質 反応まとめ 受験の月




化学式 一覧




化学式 組成式 分子式 示性式 構造式の違いと見分け方を具体例で解説




元素 記号 Cl 化学 好きな元素ランキング
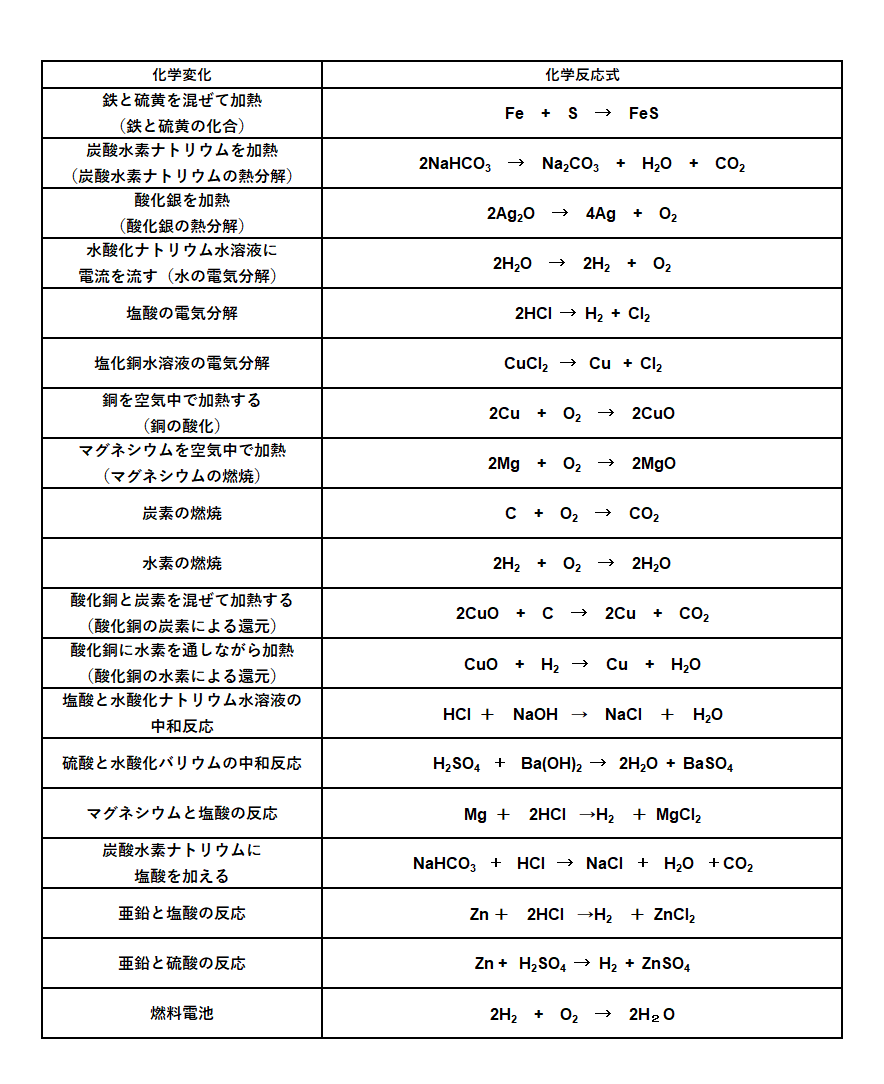



中2化学 化学反応式 中学理科 ポイントまとめと整理




中学理科 高校入試 化学反応式一覧まとめと問題




化合物 Minecraft Wiki



酸化還元反応を解説 酸化数を理解して半反応式を覚えよう Studyplus スタディプラス



5分でわかる 中和反応とは 化学反応式と計算問題の解き方 練習問題付き サイエンスストック 高校化学をアニメーションで理解する




高校無機化学 揮発性酸の遊離反応 受験の月




初心者にもすぐわかる 精油の化学の基礎 成分から化学的に分類 Timeless Edition




フライング エッグ株式会社 今回の開発商品ポスターは 化学式一覧表 です Facebook



酸 塩基 塩基の価数と強弱は周期表でおさえる 基本に忠実に本質を伝える 楽天ブログ




化学式 イオン式 一覧 中学生 理科のノート Clear




高校化学が苦手な受験生必見 化学反応式の覚え方のコツをご紹介 予備校いくなら逆転合格の武田塾




Kohは強塩基ですか 弱塩基ですか Clear




化学式の一覧や覚え方 中学生が覚えておきたい化学式 三重の個人契約家庭教師




絶対忘れない 強酸 強塩基のゴロ合わせ Youtube



酸 塩基 価数 一覧 覚え方 例など 化学のグルメ




Amazon お風呂学習ポスター 受験教材 化学式一覧表 化学 おもちゃ




塩の加水分解 理系ラボ



ピクリン酸 化学式ピアス 片耳 Iichi ハンドメイド クラフト作品 手仕事品の通販




理科 中2 7 化学反応式の作り方 Youtube



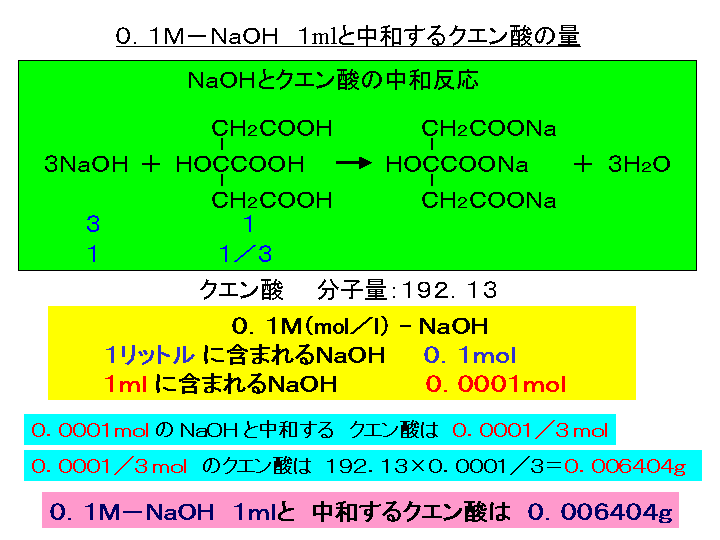
1 重曹って何だろう クエン酸って何だろう 重曹 クエン酸で地球に優しいお掃除はじめませんか 木曽路物産株式会社




センター試験にでる化学反応式 数学 化学講師 佐藤学による受験生に役立つ濃縮ポイントと Etc
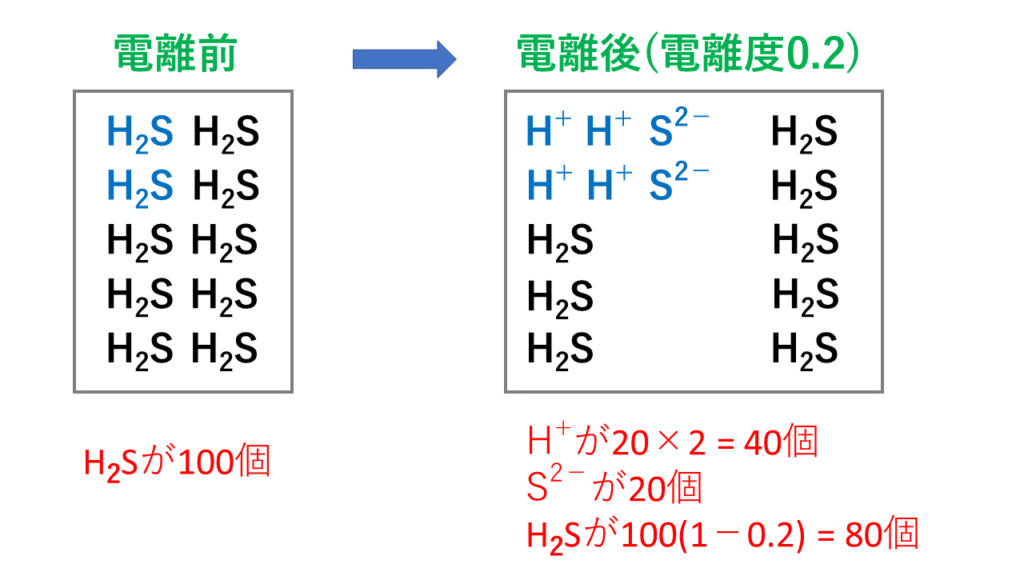



完全版 電離度の意味と強酸 強塩基 弱酸 弱塩基と一覧 サイエンスストック 高校化学をアニメーションで理解する



電離式の小テスト 3年理科 Takaの授業記録11




6 1 酸と塩基 おのれー Note
.jpg)



元素 記号 Cl 化学 好きな元素ランキング




Microsoft Word Chemformbook Docx Pdf 無料ダウンロード




酸化剤 還元剤の半反応式一覧 4ステップで半反応式は書ける




電離式の一覧 中学生用




中和反応式 一覧 中和反応でできる 塩の種類と性質 中学理科 Yattoke 小 中学生の学習サイト




錯イオンの化学式と名称一覧分かる方いらしたら 教えて頂けると助かります Clear




化学式 一覧




化学式 一覧




高校理論化学 塩の種類と水溶液の性質 塩の加水分解 受験の月



リン酸銅 Ii You Iggy




高校化学 十酸化四リンとリン酸 映像授業のtry It トライイット




イオン式 電離式まとめ 中学理科 ポイントまとめと整理




Amazon お風呂学習ポスター 受験教材 化学式一覧表 化学 おもちゃ




高校化学基礎 酸と塩基の価数と強弱 映像授業のtry It トライイット




元素 化合物の種類と化学式の一覧 いちらん屋 一覧屋
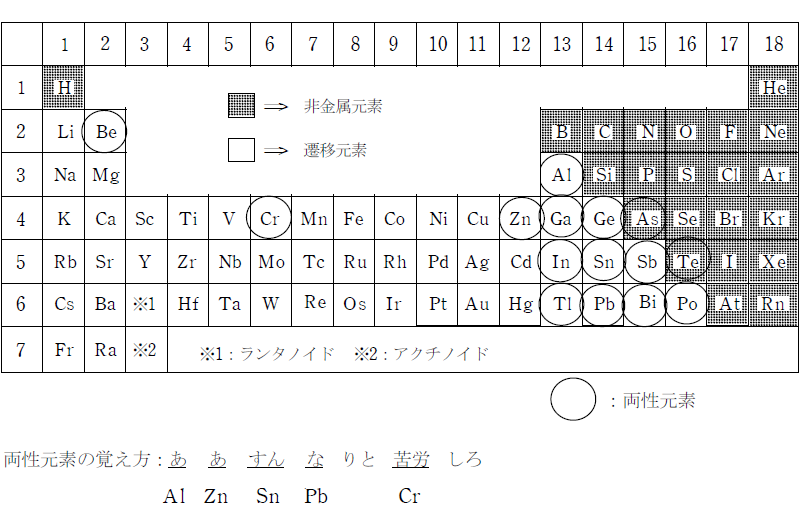



無機化学 第9回 両性元素 Al 医学部受験を決めたら 私立 国公立大学医学部に入ろう ドットコム




Amazon お風呂学習ポスター 受験教材 化学式一覧表 化学 おもちゃ
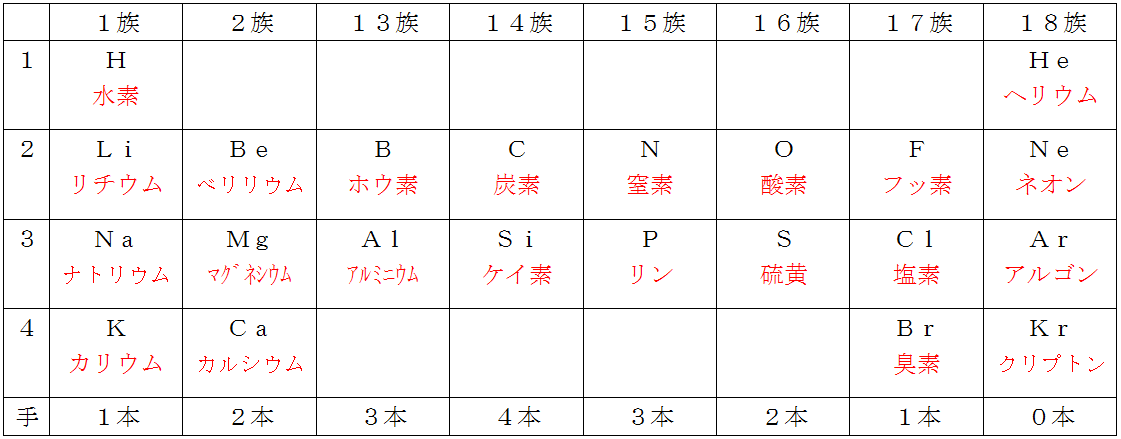



理科4ページ目 三重の個人契約家庭教師




理科 化学反応式 電離式覚えよう 中学生 理科のノート Clear
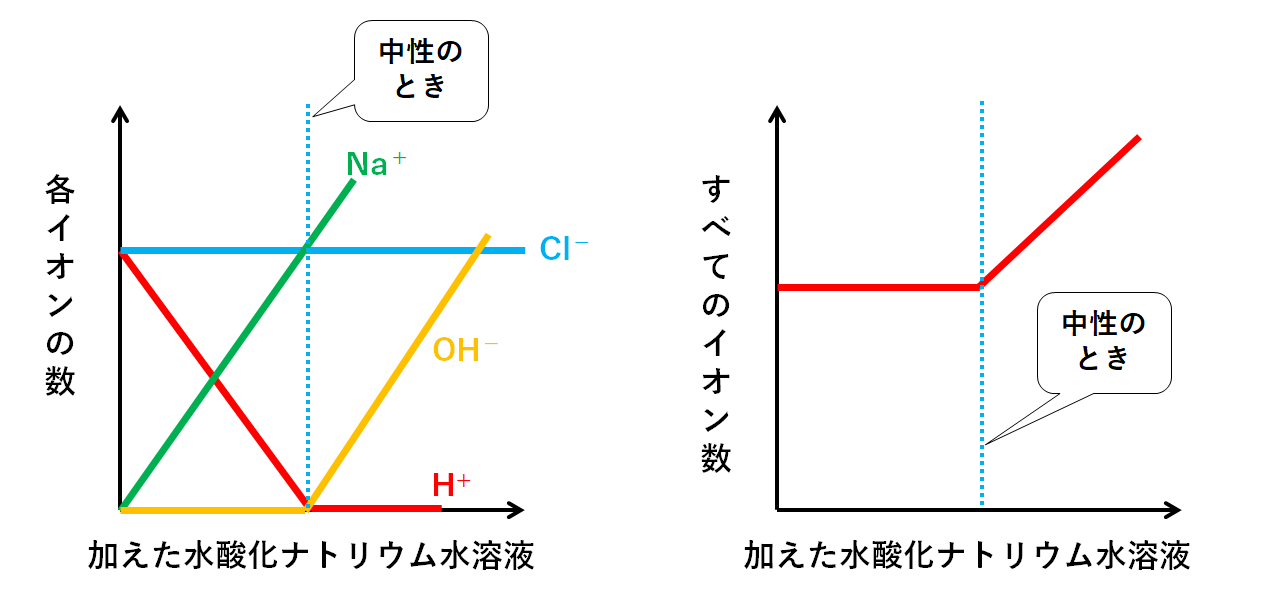



酢酸 と 水 酸化 ナトリウム の 中 和 反応 式 酸と塩基 中和反応



化学式 一覧
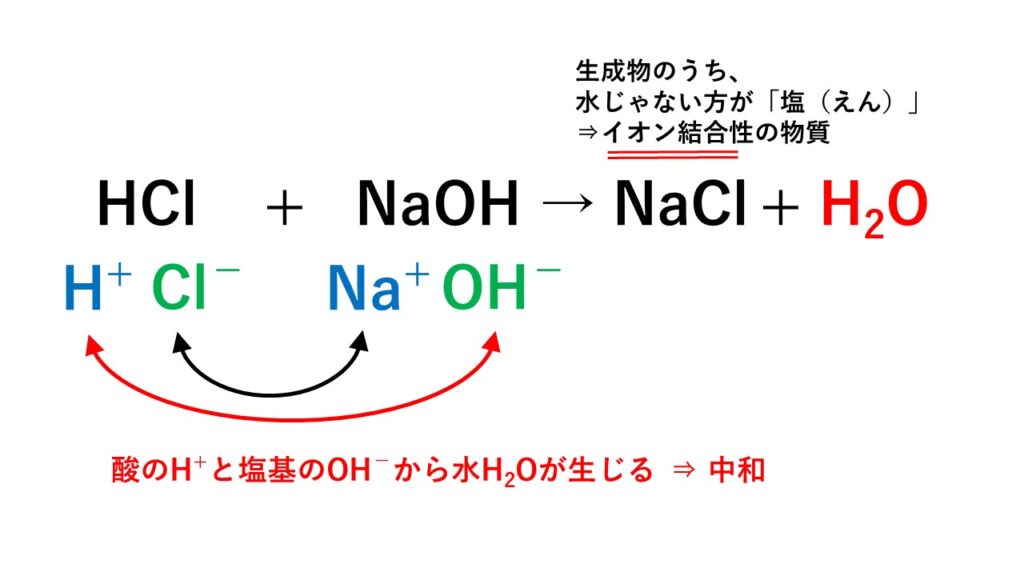



5分でわかる 中和反応とは 化学反応式と計算問題の解き方 練習問題付き サイエンスストック 高校化学をアニメーションで理解する




化学式とは 受験化学で覚えておくべき化学式を一覧にまとめてみた 化学受験テクニック塾




Amazon お風呂学習ポスター 受験教材 化学式一覧表 化学 おもちゃ




化学式 一覧




半反応式の作り方を解説 酸化剤 還元剤の見分け方と一覧表も 高校生向け受験応援メディア 受験のミカタ



化学反応式覚え方 至急お願いします 下の写真の化学反応式を全て覚えなけれ Yahoo 知恵袋




化学式 一覧




硫酸 と 水 酸化 バリウム の 中 和




化学式 一覧 化学 完全版 酸 塩基の価数の意味 覚え方 一覧と多段階電離




化学式 イオン式 一覧 中学生 理科のノート Clear
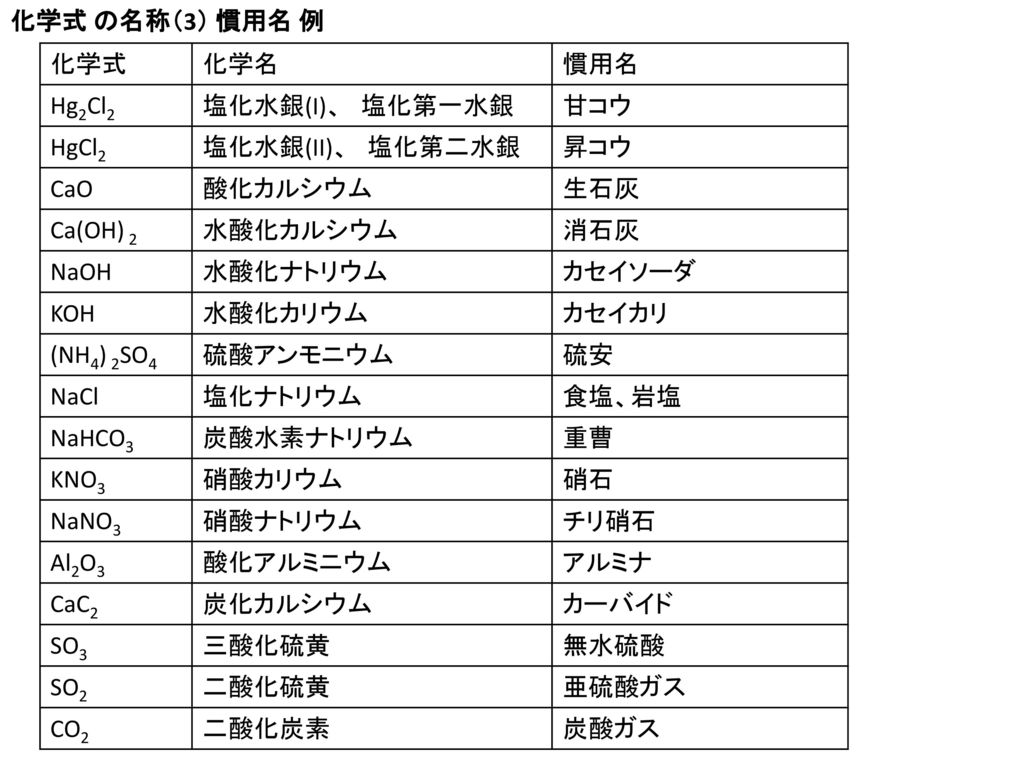



3章 イオン結合とイオン結晶 最終回 3 2 イオン結晶の構造 Ppt Download
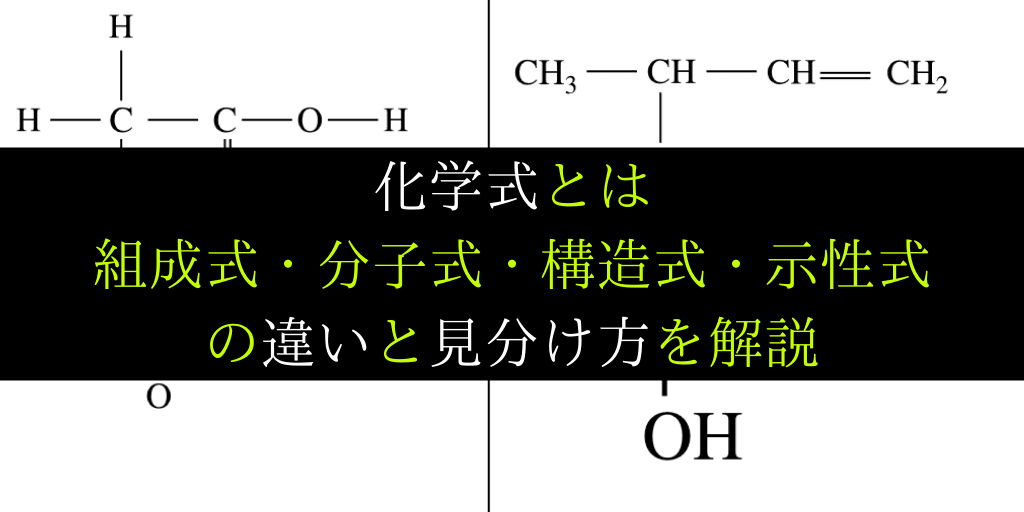



化学式 組成式 分子式 示性式 構造式の違いと見分け方を具体例で解説



リン酸 You Iggy




高校無機化学 錯イオンの配位子 配位数 立体構造 名称 錯イオン形成反応 受験の月




化学式の一覧や覚え方 中学生が覚えておきたい化学式 三重の個人契約家庭教師




化学式 Wikipedia




セ対 これだけは覚える 化学式一覧 高校生 化学のノート Clear


